活潑自信、耐性有限的行動派,甚麼都敢嘗試。擅長各類運動,特別喜歡踢足球。修習中外武術,包括跆拳道。
電池解密:「電」從何來?
電是現代都市生活中不可缺少的東西,我們每日每夜都有很多用具需要有電才能運作。為了方便攜帶,很多小型電器如電腦、手機、電筒等都能使用預先充電的電池或乾電池。
電池與我們的生活息息相關,到底它的內部構造是怎樣的?它又是如何「發電」的?
逃跑的自由電子
最常見的電池材料都是用金屬造的,因為金屬能夠導電。金屬含有可「自由走動」的電子,在特定的情況下,電子還會從金屬中「逃出來」,就如金屬在「放電」。

有些金屬的電子十分活躍,一旦情況許可,就會立即逃跑,這些金屬具有較強的放電傾向。也有些金屬的電子比較文靜,不會怎麼逃跑。
金屬原本是不帶電荷的,因為它內部有相同數目的正電和負電荷粒子,彼此電荷會互相抵消。但當帶負電荷的電子逃走後,金屬整體的負電荷便會減少,使整體帶正電荷。同樣,電子逃到另一邊的金屬後,會令該金屬的負電荷增加,使它整體帶負電荷。
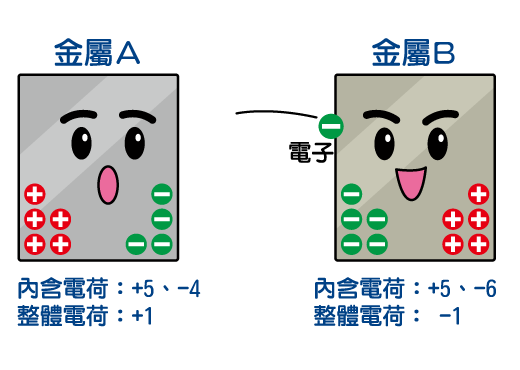
相同電荷會互相排斥,相異會互相吸引。因此電子會愈來愈難離開帶正電荷的金屬,也愈來愈難進入帶負電荷的另一金屬。於是,電流很快便會停止。所以,如果就這樣把兩種金屬連接起來,是不會產生電流的。

引導電流產生
若我們利用鹽水,可使金屬間產生電流。當把兩片浸在鹽水中的電極(不同的金屬片)連接電路,電子較活躍的一方便會放電。電子沿電線走向另一端電極,並為途經的裝置(例如馬達或燈泡)提供電力。
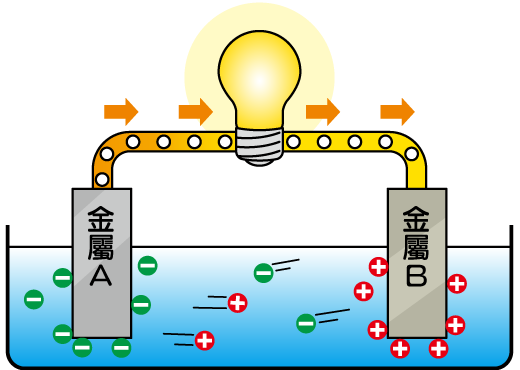
當金屬片因放電而變成正電荷,帶負電荷的自由離子(負離子)便會被它吸引而在電極上聚集,如此一來,電極的正電荷便被抵消了。同樣,另一邊因吸收電子而帶負電荷的電極會吸引正離子,把負電荷抵消。因此在電種離子的抵消作用下,兩邊電極便能保持中性,電子便可以繼續流動,提供穩定的電力。
鹽水能導電,因當中包含大量帶電荷的自由離子,例如由食鹽分解而來、帶負電荷的氯離子和帶正電荷的鈉離子。像鹽水這種以用自由離子來導電的物質,稱為「電解質」。
解構乾電池
日常使用的乾電池,其實原理與利用鹽水導電是相同的。
電池的正極和負極是兩種具不同放電傾向的物質(不一定是金屬),放電傾向較強的會作為負極。兩極之間沒有直接接觸,以電解質溶液分隔。電解液的成分視乎電極物質而定。電池外側會以絕緣物質密封,以防電解液滲漏或乾涸。由於電池中的電解液已經過特製成為糊狀/粉狀而非液態,因此稱作「乾電池」。
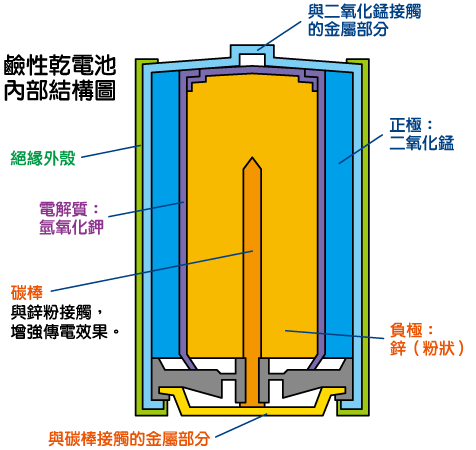
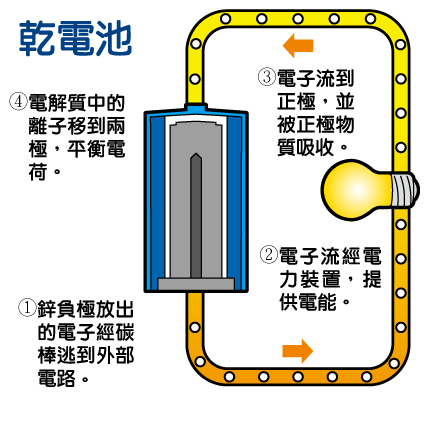
乾電池的發電原理:
- 鋅負極放出的電子經碳棒逃到外部電路。
- 電子流經電力裝置(如燈泡),提供電能。
- 電子流到正極,並被正極物質吸收。
- 電解質中的離子移到兩極,平衡電荷。
五花八門的電池
電池和電力實在為人們帶來很多的便利,歷史上一代又一代的科學家不斷投入精力和時間,期望研發效果更佳的電池。今時今日的電池已經發展得相當多元化啦。
鹼性電池
最常見的乾電池,1950年代由一位加拿大化學工程師發明。輸出電壓1.5伏特,不可充電再用。因使用鹼性的氫氧化納作電解液而得名。

蓄電池
可反覆充電再用,種類繁多,材料、電壓和形狀亦大有不同。目前較流行的是鎳氫電池和鋰離子電池,前者多為AA型號充電池,後者則多用於相機等器材。

燃料電池
以外加燃料及氧氣的化學反應來製造電力,只要燃料不耗盡,就可以一直穩定供電。目前最常使用的燃料是氫。電壓只有0.7伏特左右,但可透過串聯來提高。
由於效率高、污染低,相信會成為未來環保能源的重點。
空氣電池
利用空氣中的氧作正電極,負極則一般使用鋅、鋰、鋁或鎂,每一種的電壓也不同,從1.2至3伏特不等。空氣電池能在較小體積中儲起更多電力,而且成本不高,但充電再用的效率很低。
木頭電池
美國馬里蘭大學幾年前曾發表了利用極薄木片製作電池的研究。由於木纖維能保存含豐富礦物的水分(電解質),加上能抵受超過400次充電且能保特完整,因此非常適合用於電池中。
本文由《兒童的科學》提供。


